
Estequiometría: Definición y Concepto Clave en Química
- La estequiometría, vital en la química contemporánea, es el estudio de las proporciones numéricas entre elementos en sustancias y reacciones.
- Originada por Jeremías Benjamin Richter en el siglo XVIII, se basa en la invariabilidad de la materia, destacando la importancia de la ley de conservación.
- Utiliza el mol como unidad para cálculos precisos, donde los coeficientes determinan las proporciones reactantes.
- Fundamental para elaborar productos químicos y ajustar reacciones, la estequiometría se apoya en ecuaciones balanceadas y tecnología avanzada para abordar procesos complejos, manteniendo un equilibrio químico eficaz en la creación y análisis de sustancias.
La estequiometría emerge como la columna vertebral de la química moderna, guiándonos a comprender la intrincada danza de átomos y moléculas. A través de su lente, el universo químico revela sus proporciones y patrones, permitiéndonos predecir y manipular reacciones con precisión asombrosa.
Este artículo desplegará un exhaustivo análisis de la estequiometría, desde sus cimientos hasta sus aplicaciones prácticas más impactantes. Prepárate para embarcarte en un viaje a través del fascinante mundo de las relaciones numéricas en la química.
Definición de estequiometría
Origen histórico del término
La estequiometría, un pilar fundamental de la química, debe su nombre a Jeremias Benjamin Richter, quien en el siglo XVIII, acuñó el término derivado de las palabras griegas "stoicheion" (elemento) y "metron" (medida). Richter, a través de su obra, inauguró un nuevo paradigma: el entendimiento de que las reacciones químicas se rigen por relaciones numéricas exactas entre los elementos involucrados. Este concepto revolucionario sentó las bases para lo que hoy conocemos como estequiometría, transformando radicalmente nuestra capacidad para analizar y predecir resultados químicos.
Importancia en la química actual
En la química contemporánea, la estequiometría no es solo una herramienta analítica; es un lenguaje universal que permite a los científicos de todo el mundo comunicar sus descubrimientos y experimentos con precisión y claridad inigualables. La capacidad para calcular la proporción exacta de reactivos y productos en una reacción química es fundamental en campos tan diversos como la farmacología, la ingeniería ambiental y la industria alimentaria, demostrando la versatilidad y el impacto omnipresente de la estequiometría.
Conceptos fundamentales
Ley de conservación de la materia
Un eje central en la estequiometría es la ley de conservación de la materia, establecida por Antoine Lavoisier en el siglo XVIII. Este principio sostiene que, en una reacción química, la masa total de los reactivos es siempre igual a la masa total de los productos. Esta ley es el fundamento sobre el cual se construyen todos los cálculos estequiométricos, permitiendo equilibrar ecuaciones y predecir las cantidades de sustancias en cualquier proceso químico.
El mol como unidad básica
El mol, definido como la cantidad de sustancia que contiene tantas entidades elementales (átomos, moléculas, iones, etc.) como átomos hay en 12 gramos de carbono-12, constituye la piedra angular de la estequiometría. Esta unidad facilita la conversión entre la escala atómica y la macroscópica, brindando un puente entre el micro y el macro universo. Gracias al mol, los científicos pueden cuantificar y manipular con exactitud las sustancias involucradas en las reacciones químicas.
Cálculos estequiométricos esenciales
Interpretación de coeficientes
En el corazón de la estequiometría yacen los coeficientes estequiométricos, los cuales indican en una ecuación química balanceada, la proporción exacta entre reactantes y productos. Estos números no solo reflejan la cantidad de partículas involucradas sino también la masa y el volumen, bajo condiciones específicas, que cada sustancia aporta o requiere en la reacción.
Balances de masa en ecuaciones
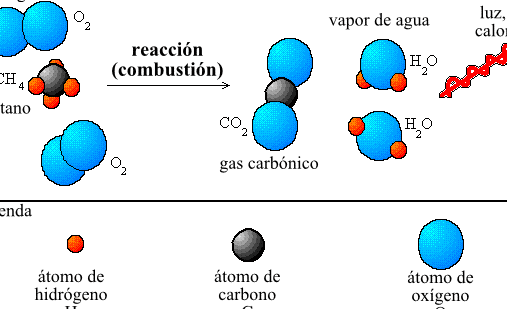
El arte de balancear ecuaciones químicas es fundamental para realizar cálculos precisos. Este proceso involucra ajustar los coeficientes estequiométricos para asegurar que la cantidad de masa se conserve, respetando así la ley de Lavoisier. A través de esta técnica, los químicos pueden determinar exactamente cuánto de cada reactivo necesitan y cuánto producto esperar, optimizando así los recursos y la eficiencia de sus experimentos o procesos industriales.
Aplicaciones prácticas de la estequiometría
Creación de productos químicos
La estequiometría es indispensable en la síntesis química, permitiendo a los científicos y a la industria fabricar compuestos con proporciones precisas. Esta precisión es crucial para desarrollar medicamentos eficaces, materiales innovadores y sustancias químicas especializadas, maximizando la eficiencia y minimizando el impacto ambiental de los residuos.
Determinación de proporciones en reacciones
En el laboratorio y en la industria, la estequiometría sirve como guía para determinar las cantidades óptimas de reactantes, garantizando que las reacciones se completan con la mayor eficiencia posible. Esta capacidad para predecir y manipular las proporciones químicas es fundamental en la fabricación de alimentos, bebidas, combustibles y una gran variedad de productos de consumo diario.
Herramientas para cálculos complejos
Software especializado en estequiometría
En la era digital, el avance tecnológico ha proporcionado potentes herramientas de software diseñadas específicamente para realizar cálculos estequiométricos complejos. Estos programas no solo automatizan los cálculos, sino que además permiten modelar reacciones y predecir resultados con una precisión sorprendente, acelerando la investigación y el desarrollo en múltiples disciplinas químicas.
Estrategias para el equilibrio químico
Los cálculos estequiométricos también juegan un papel crucial en la comprensión y manipulación del equilibrio químico. A través de estos, los científicos pueden determinar las condiciones óptimas para que una reacción alcance el equilibrio, maximizando la producción de productos deseados y minimizando la formación de subproductos o residuos no deseados. Esta habilidad para dirigir el curso de las reacciones químicas es invaluable en el diseño de procesos sostenibles y eficientes.
Conclusión
En definitiva, la estequiometría constituye un pilar esencial en el vasto campo de la química. Su aplicación abarca desde la síntesis elemental de compuestos hasta el diseño de procesos industriales complejos, demostrando su versatilidad e impacto en el avance científico y tecnológico. Al dominar la estequiometría, los científicos pueden tejer la tela de la materia misma, manipulando los bloques constructivos del universo para beneficiar a la humanidad.
Video Relacionado sobre Estequiometria
FAQ Acerca de Estequiometria
¿Qué introdujo Richter en estequiometría?
La contribución de Richter a la estequiometría se fundamenta en la idea revolucionaria de que los elementos químicos se componen de partículas idénticas conocidas como átomos y que durante una reacción química, la cantidad de materia se conserva, es decir, no se crea ni se destruye. Esta conceptualización sentó las bases para entender que las relaciones de masa de los elementos en las sustancias y reacciones son fijas y predecibles, lo que permitió el desarrollo de cálculos más precisos y el establecimiento de una relación numérica clara entre los componentes de una reacción. Así, se abrió el camino para una comprensión más profunda de cómo las cantidades específicas de diferentes sustancias reaccionan entre sí, guiando la formulación y balance de ecuaciones químicas, elementos centrales en la estequiometría moderna. Este avance también llevó al reconocimiento de la importancia de la unidad del mol en la química, facilitando la cuantificación y comparación de las masas involucradas en las reacciones.
¿Por qué es vital la ley de conservación?
La ley de conservación de la materia es crucial en estequiometría ya que establece que, en una reacción química, la cantidad total de materia permanece constante, es decir, no se produce una creación o destrucción neta de materia. Este principio es fundamental porque asegura que las ecuaciones químicas deben estar balanceadas, reflejando una igualdad entre la masa de los reactantes y los productos. Dicha ley permite realizar cálculos precisos de las proporciones en que las sustancias reaccionan y se forman, facilitando la predicción y cuantificación de los resultados de las reacciones químicas. Sin esta ley, sería imposible desarrollar formulas o métodos sistemáticos para determinar cantidades específicas de sustancias requeridas o producidas en procesos químicos, lo que es esencial tanto en la investigación científica como en aplicaciones industriales y cotidianas.
¿Qué es un mol en estequiometría?
El mol es una unidad de medida fundamental en la química utilizada para expresar cantidades de sustancias. En estequiometría, el mol juega un papel vital ya que permite cuantificar los elementos y compuestos en términos de un número específico de entidades, sean estos átomos, moléculas, iones, electrones, u otras partículas. Un mol corresponde a (6.022 times 10^{23}) unidades de dicha sustancia, número conocido como el número de Avogadro. Este concepto es esencial porque proporciona un método para convertir entre masas atómicas o moleculares y cantidades mensurables de sustancias, facilitando la realización de cálculos estequiométricos precisos. Gracias al uso del mol, se pueden establecer relaciones entre las proporciones en masa de los reactivos consumidos y los productos formados en una reacción química.
¿Cómo se balancean las ecuaciones?
Balancear ecuaciones químicas implica asegurar que la cantidad de átomos de cada elemento sea la misma tanto en los reactantes como en los productos, respetando la ley de conservación de la materia. Este proceso empieza identificando todos los elementos involucrados en la reacción y contabilizando el número de átomos de cada uno en ambos lados de la ecuación. A continuación, se ajustan los coeficientes estequiométricos, que son números situados delante de las fórmulas de los reactivos y productos, para igualar la cantidad de átomos de cada elemento en los dos lados. Este ajuste se hace de manera sistemática, atendiendo primero a los elementos que aparecen en menor cantidad y avanzando hacia aquellos presentes en varias sustancias de la ecuación. La correcta utilización de estos coeficientes asegura que se reflejen fielmente las proporciones en las que las sustancias reaccionan, constituyendo una herramienta indispensable para llevar a cabo cálculos estequiométricos en la práctica química.
¿Qué significan masa molar y peso molecular?
La masa molar y el peso molecular son dos conceptos fundamentales en la comprensión de las cantidades en química, especialmente en estequiometría. La masa molar se refiere a la masa de un mol de sustancia (elemento o compuesto) y se expresa en unidades de gramos por mol (g/mol). Esta se calcula sumando las masas atómicas individuales de los átomos presentes en una fórmula química, proporcionando una manera de convertir entre moles de sustancia y su masa en gramos. Por otro lado, el peso molecular, técnicamente similar al peso fórmula para compuestos iónicos, es la suma de las masas atómicas de todos los átomos en una molécula de una sustancia covalente. Ambos conceptos son esenciales para realizar cálculos estequiométricos, ya que permiten determinar la cantidad de reactivos y productos involucrados en una reacción química con base en sus relaciones de masa.
Si quieres conocer otros artículos parecidos a Estequiometría: Definición y Concepto Clave en Química puedes visitar la categoría CIENCIAS.
Deja una respuesta



También te puede interesar: